診断のポイント
低ホスファターゼ症 (Hypophosphatasia; HPP)は、臨床症状、放射線学的所見および生化学検査所見から診断されます。血清アルカリホスファターゼ (ALP) 値の低下は重要な所見ですが、年齢や性別に応じた基準値と比較する必要があります。確定診断のためには遺伝子検査を行うことが推奨され、保険適用になっています。厚生労働省科学研究費補助金難治性疾患克服研究事業「低フォスファターゼ症の個別最適化治療に向けた基礎的•臨床的検討」班が作成した診断基準 (下記) が難病情報センターのWebサイトや低ホスファターゼ症診療ガイドラインに掲載されています。診療ガイドラインについては別項に記載していますのでご参照ください。
低ホスファターゼ症の診断基準
主症状
1.骨石灰化障害
骨単純X線所見として骨の低石灰化、長管骨の変形、くる病様の骨幹端不整像
2.乳歯の早期脱落(4歳未満の脱落)
主検査所見
血清アルカリホスファターゼ(ALP)値が低い(年齢別の正常値に注意)
参考症状
1.ビタミンB6依存性けいれん
2.四肢短縮、変形
参考検査所見
1.尿中ホスホエタノールアミンの上昇(尿中アミノ酸分析の項目にあり)
2.血清ピロリン酸値の上昇
3.乳児における高カルシウム血症
遺伝学的検査
確定診断、病型診断のために組織非特異型ALP(TNSALP)遺伝子検査を行うことが望ましい
参考所見
1.家族歴
2.両親の血清ALP値の低下※
(※妊婦においては、胎盤由来のALPのためALP値が上昇する)
診断のカテゴリー
主症状1つ以上と血清ALP値低値があれば本症を疑い遺伝子検査を行い確定診断する (Definite)。指定難病においては、Definite例を対象とする。
ALP の年齢別・男女別基準値
(IFCC法、単位U/L)
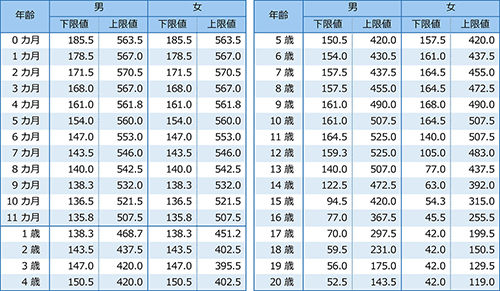
出典/田中敏章編著:ALP(アルカリフォスファターゼ)、小児の臨床検査基準値ポケットガイド第2版、p46、2014年、じほう
(許諾を得て転載. 転載部分は2020年第3刷で変更されており、上記は変更後のもの)
↑ PAGE TOP
放射線学的所見
HPP患者の骨単純X線検査では、年齢や重症度により、さまざまな程度の骨石灰化障害、くる病様骨変化、骨変形、骨折、偽骨折などの所見を認めます。周産期重症型では、全身骨の著明な石灰化障害、膜様頭蓋、小さな胸郭などが認められます。周産期良性型では、骨石灰化障害はあまり明らかではありませんが、長管骨の彎曲が特徴的で、腓骨や尺骨にspurと呼ばれる骨棘を認める場合もあります。乳児型ではくる病様骨変化、骨幹端の舌様透亮像 (tongue of radiolucency) などを示します。小児型もくる病様骨変化を示します。頭蓋骨縫合早期癒合を来した症例では、頭部単純X線検査で銅箔状頭蓋を呈する場合があります。また、成人期のHPP患者においては、骨折、治癒不良な中足骨の疲労骨折、偽骨折(Looser’s zone)、非定型大腿骨骨折などの所見が認められます。関節周囲などにピロリン酸カルシウムの蓄積 (calcium pyrophosphate deposition; CPPD) による異所性石灰化を認める場合もあります。
骨密度低下を検出するためにはDXAが行われます。また、MRIは疲労骨折や不全骨折、骨髄浮腫の検出に有用です。周産期重症型や周産期良性型のHPPでは、胎児超音波検査にて骨石灰化障害、長管骨の短縮や変形が検出可能であり、早期診断に有用です。
↑ PAGE TOP
血液・尿検査所見
HPPにおいては血清ALP値が低下を示します。通常の生化学検査で測定されるALP値は活性値です。血清ALP活性値は年齢により変動し、性別によっても異なるため、測定値の評価の際にはそのことを念頭に置く必要があります。小児期には血清ALP値は成人より高い値を示しますが、検査施設によっては結果の報告時に年齢別の基準値を設定されておらず、小児としては低い値であっても警告が出ないことがありますので、注意が必要です。また、血清ALP値の低下は、HPP以外にもさまざまな原因で認められます。たとえば、甲状腺機能低下症や栄養不良、亜鉛欠乏症やマグネシウム欠乏症、ステロイド投与などは血清ALP値の低下を伴う場合があります。また、EDTAやクエン酸、シュウ酸などを含む検体では亜鉛やマグネシウムなどがキレートされるためにALP活性の測定値が低くなってしまいます。従って、HPPを疑う際には、ALPの測定は複数回行い、また、ALP活性に影響を及ぼす様々な要因の有無を調べる必要があります。
我が国ではこれまで、血清ALP値の測定に日本臨床化学会勧告法 (JSCC法) が用いられてきました。しかし、国際治験などが推進される中で、臨床的有用性と国際標準化を図るため、2020年4月から1年をかけて、国際臨床化学連合勧告法 (IFCC法) に変更されることになりました。IFCC法によるALP測定値はJSCC法による測定値の約1/3となります。しかし、IFCC法による測定値は、小腸型ALPを多く含む検体ではより低値となり、胎盤型ALPを多く含む妊娠中の検体ではより高値となるので注意が必要です。
HPPにおいては、TNSALPの基質であるホスホエタノールアミン (PEA) やピリドキサール-5'-リン酸 (PLP)、ピロリン酸などが分解されずに体内に蓄積するため、尿中PEA値や血中PLP値が上昇を示します。PEAはアミノ酸分析の項目に含まれており、尿中排泄量の評価のためには通常、クレアチニン濃度で補正を行います。PLPは鋭敏な指標ですが、我が国では研究レベルでの測定にとどまっています。また、ピロリン酸濃度の測定も測定機関が限られ、あまり行われておりません。
また、HPPにおいては骨へのカルシウムの蓄積が障害されているため、高カルシウム血症や高カルシウム尿症を示す場合があります。特に、乳児型HPPでは高カルシウム血症を伴うことが多く、本疾患を疑うべき重要な所見の一つです。
↑ PAGE TOP
ALPL遺伝子検査
HPPは、典型例であれば臨床像とX線所見、生化学検査所見から診断可能です。しかしながら、血清ALP値の低下はHPP以外にもさまざまな病態に伴うため、確定診断と再発リスク予測、遺伝カウンセリングのために、ALPL遺伝子検査が推奨されます。我が国においては、HPP診断のためのALPL遺伝子検査は保険適用になっており、かずさ遺伝子検査室などで検査が行われています。
周産期重症型や乳児型などの重症型HPPは通常、常染色体劣性(潜性)遺伝形式を示し、両アレルに病的変異 (pathogenic variant) を有するホモ接合体もしくは複合ヘテロ接合体です。一方、周産期良性型、小児型、成人型、歯限局型などの軽症型HPPにおいては、常染色体劣性(潜性)遺伝形式を示す家系に加え、片アレルにのみ病的変異を有する常染色体優性(顕性)遺伝形式を示す家系も存在します。HPPでは新生変異はほとんど無く、常染色体劣性(潜性)遺伝家系であれば両親は一方のアレルにヘテロ変異を有する保因者(carrier)です。保因者は通常、無症状ですが、血清ALP値低下などの生化学的異常はしばしば認められ、中には軽微な症状を認める場合もあります。一方、常染色体優性(顕性)遺伝家系で同定される片アレル性ヘテロ変異は、多くの場合dominant negative作用を有し、野生型(正常)ALPの機能を阻害することによりHPPを発症します。
ALPL遺伝子の病的変異の保有者には無症状の保因者も含まれるため、ALPLに病的変異が検出されただけではHPPとは診断されません。「疾患概要・病型分類」の項などに記載したHPPに起因する症状を有している場合に、ALPL遺伝子の病的変異が検出されればHPPと確定診断されます。
これまで、400を超えるALPL遺伝子変異がHPPの原因として同定されています。これらの変異はフランスのDr. Ethienne Mornetによって運営されているALPL変異データベースに集積されています。2020年5月末までにこのデータベースに集積された410の病的変異については、ミスセンス変異が71.2%、小さな欠失が11.0%、スプライシング変異が4.9%、ナンセンス変異が4.6%、小さな挿入が3.4%、大きな欠失/重複が2.9%、挿入/欠失が1.5%、制御領域の変異が0.5%となっています。すなわち、変異のうち95%はシークエンス解析で検出可能です。
日本人のHPPにおいては、以下の2つの変異が高頻度に検出されます (Michigami, et al. Eur J Pediatr, 2005; Michigami, et al. Calcif Tissue Int, 2020)。これらの変異は海外では報告がなく、日本人に特有の変異と考えられています。
日本人HPPで高頻度に検出される変異
塩基変化
アミノ酸変化(標準表記法)
アミノ酸変化(以前の表記法)
残存活性
c.1559delT
c.979T>C
p.Leu520ArgfsX86
p.Phe327Leu
Leu503ArgfsX86
Phe310Leu
活性をほぼ喪失
野生型の70%程度
※塩基番号はHuman Genome Variation Society (HGVS)の推奨に従い、開始コドンATGのAを+1としてカウントしています。
※アミノ酸番号については、標準表記法ではHGVSの推奨に従い、開始コドンATGを1番としてカウントしています。一方、2009年頃より以前の論文で使用されていた表記法では、シグナルペプチドの17アミノ酸を除いた成熟ALPにおける番号が使用されており、すなわち開始コドンは−17とカウントされていました。
日本人で最も頻度が高いc.1559delT(p.Leu520ArgfsX86)変異は、劣性(潜性)遺伝家系で同定される変異で、活性をほぼ完全に喪失しています。日本人の一般集団において、一方のアレルにこの変異を有する保因者は1/480人と比較的高い頻度で存在することが報告されています (Watanabe, et al. J Hum Genet, 2011)。HPPの日本人症例98名を対象とした私達の解析では、c.1559delT変異は頻度が高いのでさまざまな病型で検出されましたが、c.1559delT変異のホモ接合体18名は全例、周産期重症型に分類されました。この解析では、周産期重症型は45名で、そのうち18名(40%)がc.1559delT変異のホモ接合体であり、22名(48.9%)がc.1559delT変異と他の変異の複合ヘテロ接合体でした (Michigami, et al. Calcif Tissue Int, 2020)。活性をほぼ完全に喪失しているc.1559delT変異の頻度が高いことが、日本人のHPPにおいて周産期重症型が多い理由であると考えられます。
日本人のHPPで2番目に高い頻度で検出されるp.Phe327Leu変異は、周産期良性型と強く関連しています。前述の日本人症例98名を対象とした解析では、周産期良性型22名のうち20名(90.9%)がp.Phe327Leuと他の変異の複合ヘテロ接合体でした (Michigami, et al. Calcif Tissue Int, 2020)。歯限局型の中にも、p.Phe327Leuと他の変異の複合ヘテロ接合体である症例が同定されました。p.Phe327Leu変異体は高い残存活性を有し、このことがこの変異を有する症例の良好な生命予後に寄与していると推察されます。また、p.Phe327Leu変異の頻度が高いことが、日本人HPPにおいて、海外ではまれな周産期良性型が多い原因になっていると考えられます。ただし、同じ変異の組み合わせを有する症例においても、症状の強さには若干のばらつきが認められます。
また、ALPL遺伝子には多型がいくつか知られています。蛋白質コード領域の多型としては、p.Ser110Ser (c.330C>T)、p.Arg152His (c.455G>A)、p.Asn170Asn (c.510C>T)、p.Tyr263His (c.787T>C)、p.Pro292Pro (c.876A>G)、p.Lys422Lys (c.1266G>A)、p.Ala514Ala (c.1542T>G)、p.Val522Ala (c.1565T>C)などが知られており、アミノ酸が変化するものもあります。これらは無害なbenign variantであり、HPPの直接の原因にはなりません。
ALPL遺伝子検査結果の報告書を解釈する際には、検出されているvariantが病的変異 (pathogenic variant) であるのか、それとも多型などの無害なbenign variantなのか、確認する必要があります。また、片アレルにのみ病的変異が検出されている場合には、その変異が優性(顕性)変異であればHPPの罹患者である可能性がありますが、劣性(潜性)変異であれば保因者であると考えられます。前述のDr. Ethienne Mornetによって運営されているALPL変異データベースには、各変異がどの病型の症例で同定されたか、残存活性、ドミナントネガティブ作用の有無などさまざまな情報が掲載されていますので、ぜひ、活用していただきたいと思います。
